单细胞测序是指在单个细胞水平上对DNA/mRNA进行扩增与测序的一项新技术。相比于传统的高通量测序,单细胞测序不仅能够分析同一组织内细胞间的异质性(如肿瘤细胞、干细胞),还能实现对数量极少细胞(如神经细胞、生殖细胞)的测序。
随即单细胞测序的文章呈现爆发式增长,平均每4篇就有1篇10分以上的高分文章。同时,很多优秀的科学家们都在单细胞转录组测序上做出了突出的成绩,相继发表了一系列的方法学文章。比如我们熟知的Smart-seq,Drop-seq等,单细胞转录组测序正向着高通量低成本方向发展。

图1单细胞转录组测序的文章统计
二、高通量单细胞RNA-seq的应用高通量单细胞RNA-seq指同时对成千上万个单个细胞进行转录组测序,检测各个细胞的表达和表达情况,从而大大降低了单个细胞的扩增测序成本,推动其在多领域的应用。从课程中列举的部分2018年高通量单细胞RNA-seq的高分文章可见,高通量单细胞RNA-seq在肿瘤、免疫、干细胞、神经系统及细胞图谱等研究领域都有突出的表现。
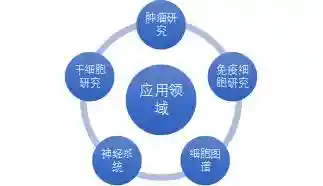
图2高通量单细胞转录组测序的应用方向
三、高通量单细胞分离的方法目前新型高通量单细胞分离技术主要有微孔芯片技术及微流控技术。
微孔芯片技术
是指通过制作孔径略大于细胞直径的微孔阵列,通过重力、流体、电场等方式将细胞悬液中的单细胞分离至微孔中的技术,其中作为代表的有WaferGen的ICELL8Single-CellSystem及BD的Rhapsody系统。
微流控技术
是指通过微米级别的流道精确操控微升、毫升级别样品的技术,目前主要有微反应室、微液滴技术。其中微反应室的代表产品有Fluidigm公司的C1单细胞自动制备系统;微液滴技术的市场代表产品主要有Illumina联合Bio-Rad推出的ddSEQSingle-CellIsolator和10xGenomics公司的Chromium™Controller。目前10xGenomics是通量最高,单细胞细胞成本最低的高通量单细胞分离平台,以下就重点介绍10xGenomics单细胞RNA-seq的原理及流程。

图3高通量单细胞分离平台
四、10xGenomics单细胞RNA-seq原理及流程10xGenomics公司的ChromiumTM系统是通过微流体“双十字”系统,将含有barcode信息的凝胶珠与样品和酶的混合物混合,然后与油表面活性剂溶液结合,形成油包水的微液滴结构,称为GEMs。
每个液滴里包含一个细胞,一个凝胶珠及相应的反应液。磁珠上偶联40-80万条oligo,每条oligo上包括22nt测序引物结合位点,16nt10xBarcode序列,10ntUMI及30nt与mRNApolyA尾结合的Poly(dT)随机引物。其中一个凝胶珠对应一种Barcode,用以标记细胞,UMI标记基因并记录表达量。
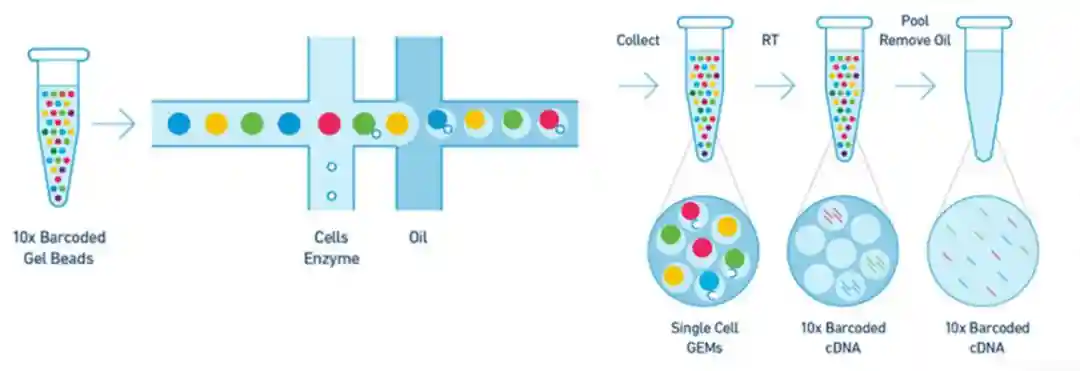
图410xGenomics单细胞捕获原理
其工作流程是:首先通过消化,洗涤重悬,过滤,细胞计数及活力检测制备符合要求的细胞样本,然后,在10xGenomics平台的双十字交叉系统制备油包水的微液滴结构,即GEMs。
GEMs形成后,细胞被裂解,凝胶珠自动溶解释放大量含barcode,UMI及oligodT的序列,随后mRNA逆转录产生带有Barcode和UMI信息的cDNA。随后油滴破碎,以cDNA为模板进行PCR扩增,然后进行cDNA打断、加测序接头P5及测序引物R1等传统二代测序的建库过程,得到双链PCR产物。双链PCR产物可以通过质检后于illumina平台测序。
同时,华大为了给大家提供更有优势的测序方案,开发了基于10xGenomics单细胞RNA-seq的测序方案。
首先对PCR产物进行转换PCR,变性为单链,再环化成单链环状DNA文库,即可用于BGISEQ-500RS或MGISEQ-2000RS平台测序。测序数据通过10xGenomics提供的CellRangerTM分析流程结合转录比对数据和标示细胞的barcode信息,进行细胞聚类、差异基因筛选、差异基因功能分析。

图5MGI基于10xGenomics平台的高通量RNA-seq解决方案
五、知识点补充1.关于样本制备
a.制备单细胞悬液:选择合适的消化酶及消化条件;
b.洗涤与重悬:推荐使用含有0.04%BSA(400μg/ml)的1XPBS溶液(无Ga、Mg)清洗、重悬细胞。对于活力敏感类细胞可以选择10x推荐的缓冲液或培养基,以确保对后续实验没有影响。
c.细胞过滤:细胞过滤主要是去除细胞团,当细胞悬液体积较小时,推荐使用Flowmi™CellStrainer细胞滤器,可减少样本损失。
d.细胞计数及活力检测:可用台盼蓝染色法检测细胞活性,用CellCounter或血球计数板进行细胞计数。若细胞活力检测时死细胞比例过大,则需用去除死细胞的试剂盒(如MACS®DeadCellRemovalKit)去除死细胞,或者重新制备细胞样品。
制备的细胞样品要求:
活细胞数在90%以上;细胞浓度在700-1200cells/µL之间;细胞培养基及缓冲液不能含有Ca2+和Mg2+等影响酶活性的物质等(这里的样品要求是10xGenomics平台的样本要求,适用于自己建库的老师,如果是外送服务公司建库,请参考服务公司的样本要求)。样本制备过程应尽量快速,最好在1.5-2h内完成,时间越长对细胞活力影响越大。
2.关于UMI
UMI是“uniquemultiplexindex”的简称,是一段10bp的随机序列,是在mRNA反转录时加到反转录得到的cDNA上,且因UMI的种类非常多,所以每个细胞内的mRNA结合不同的UMI序列,这样在经过PCR、再深度测序得到的reads,可以通过UMI判断哪些reads是来自于一个原始cDNA分子的。
这样,就可以把起始于一个原始cDNA分子,因为PCR扩增而产生的多个reads,简并成一个原始的cDNA分子。也就是可以排除因为PCR扩增效率的不同,而导致最后reads数量的偏差,也就是排除“PCRbias”。所以能更准确的定量转录本。
3.10xGenomics单细胞扩增原理
10xGenomics单细胞扩增是基于Smart-seq(SwitchingMechanismat5’ofRNATemplate)的技术原理。制备得到GEMs后,液滴中的反应液会裂解细胞,凝胶珠溶解,释放的oligo带有oligodT序列,与真核生物mRNA3‘端的polyA结合,进行反转录,转录到mRNA的5‘端时,继续合成几个无模板的C碱基。反应体系中的5’端为连续G碱基的Switcholigo与poly(C)结合,然后以Switcholigo为模板继续延伸,得到两端均为已知序列的全长cDNA。再用此两端已知序列设计的引物进行PCR扩增,得到ng级别的双链cDNA产物。所以该方法只适用于带polyA尾的真核生物mRNA的研究。
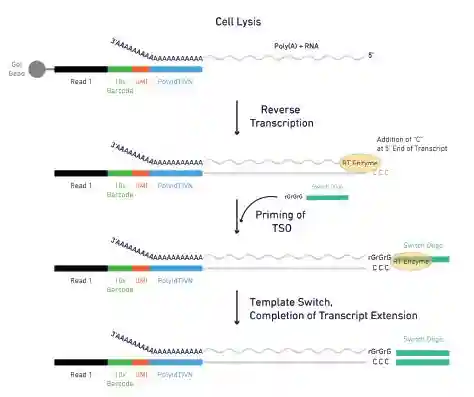
图610xGenomics单细胞转录组扩增原理
华大基因学院
您最佳的基因科技学习帮手!
































