
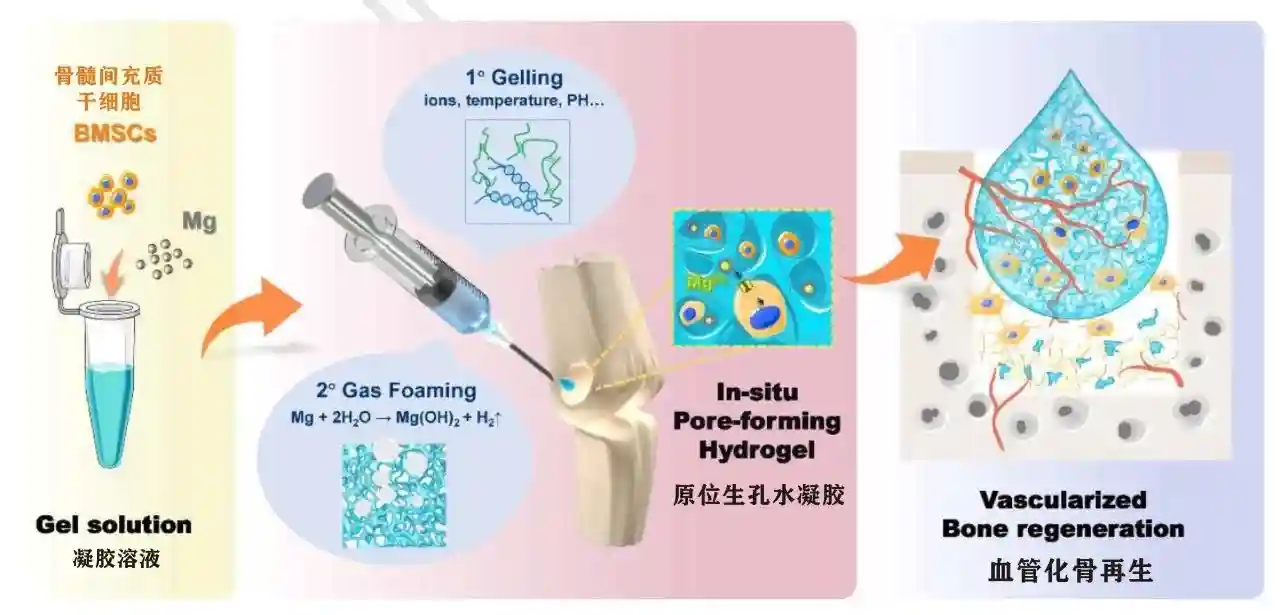
在组织工程和再生医学领域,具有高水含量和仿生细胞外基质三维结构的水凝胶,引起了研究人员的极大兴趣。封装在水凝胶中的细胞可以轻松注入目标区域,从而避免了额外的开放手术,因此,可注射水凝胶是用于组织工程中细胞递送的有吸引力的生物材料。
然而,氧气、营养物质和代谢废物在整个水凝胶中的运输主要是通过扩散来实现的。由于受到水凝胶性质的各种限制,水凝胶中心区域易形成缺氧环境,同时也缺乏营养供应,致密的聚合物网络也限制组织向内生长和周围血管浸润。这些缺点导致移植到宿主组织的细胞存活率低。
通常,利用在水凝胶中构建多孔结构来增强氧气和营养物质扩散,以促进细胞存活并促进材料与宿主组织之间的整合。目前有不少技术可在水凝胶中产生多孔结构,但遗憾的是,这些技术都会产生不可注射的水凝胶,且大多操作复杂,要求苛刻,对细胞不友好,严重限制了实际应用。
近日,上海交通大学医学院附属第九人民医院蒋欣泉团队取得新突破,开发了一种简单高效制备可注射原位生孔水凝胶的新方法。
通过将镁金属颗粒(MagnesiumParticle,简称MP)直接添加到充满细胞的水凝胶溶液中,利用镁降解过程中产生的氢气发泡。通过优化添加到水凝胶中的镁金属颗粒的大小和数量,成功制备了多孔结构,提高了细胞体内体外的存活率和增殖能力。此外,在镁降解过程中产生的镁离子促进了负载在水凝胶中的干细胞的成骨分化。
将水凝胶注射至大鼠股骨缺损,有效促进了血管化骨再生,进一步证明使用镁金属颗粒作为发泡剂是可行的,赋予可注射的水凝胶以最佳的孔隙率和增强的生物活性,为组织工程中多孔水凝胶的未来设计提供了新的策略。
该研究以Insitugasfoamingbasedonmagnesiumparticledegradation:Anovelapproachtofabricateinjectablemacroporoushydrogels为题,于2019年12月24日,在线发表于生物材料领域顶刊Biomaterials杂志(IF=10.273)上。
总的来说,该论文提出了基于镁金属颗粒降解的原位生孔方法,来制备可注射多孔水凝胶的新方法,试验结果表明,镁金属颗粒提高了细胞活力和增殖,镁离子促进了负载在水凝胶中的干细胞的成骨分化,为组织工程中多孔水凝胶的未来设计提供了新的策略。

在这项研究中,研究团队在注射水凝胶时使用镁金属颗粒发泡,从而在原位产生相互连接的孔隙。这些可注射和多孔的水凝胶与骨缺损相匹配,有利于再生过程。
首先,多孔结构促进了氧气和营养的扩散,增强了移植干细胞的生存能力和增殖能力;
其次,多孔结构使得内源性细胞和周围组织的浸润更容易,从而促进水凝胶中快速血管化。
第三,镁颗粒降解后产生的镁离子调控水凝胶中干细胞功能,刺激其成骨分化并促进骨再生。
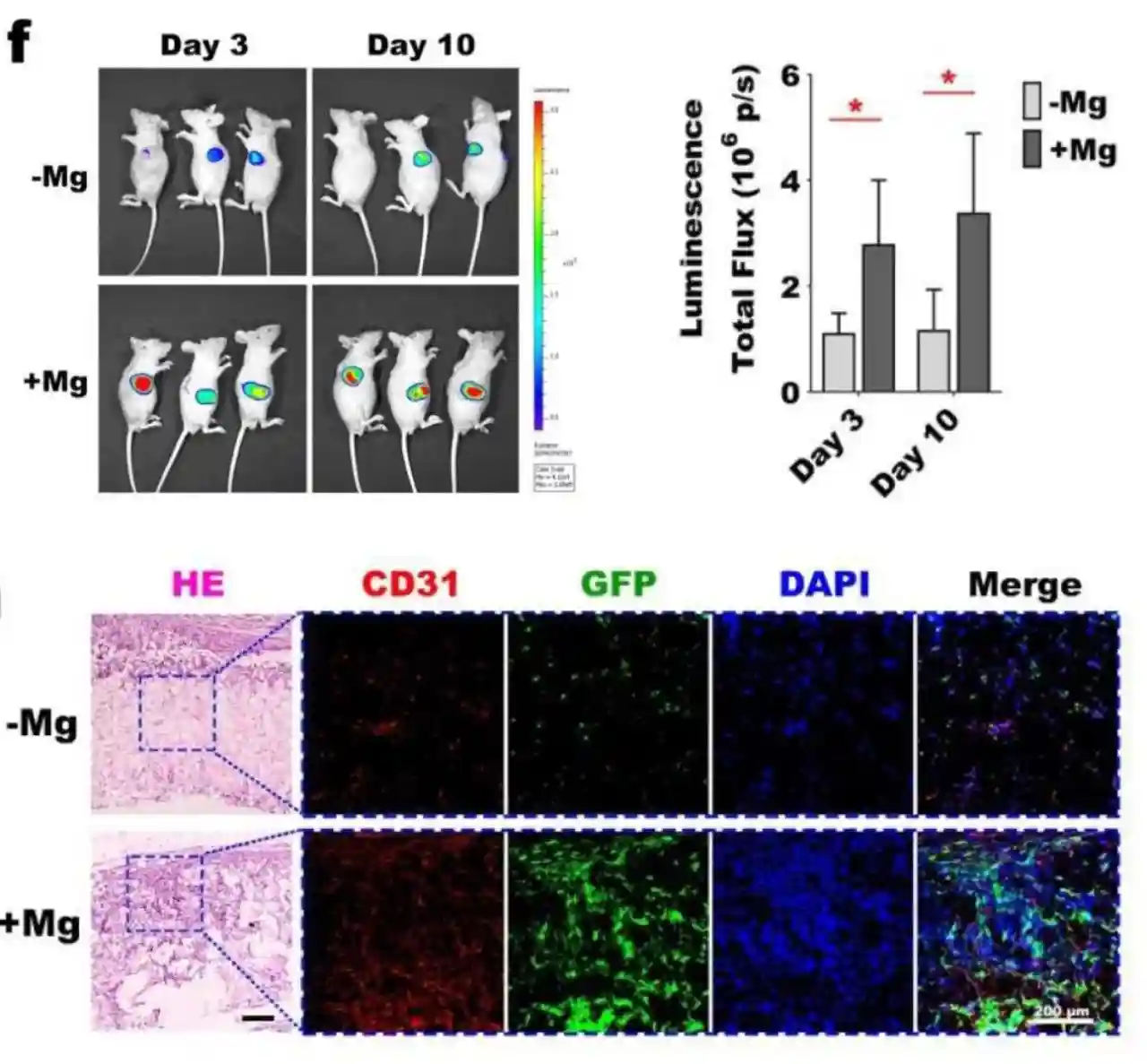
研究团队还进行了体内动物实验验证,通过携带Luciferase和GFP荧光标记的慢病毒感染小鼠3T3-L1细胞,然后使用水凝胶包裹该细胞进行裸鼠皮下移植,以追踪体内细胞存活情况。在第3天和第10天观察生物发光强度,实验结果表明,添加镁金属颗粒的多孔水凝胶组,细胞存活和增殖比对照组显著增强。
通过冷冻切片和染色进一步检查,发现实验组细胞存活率高归因于血管的大量长入,从而证实了多孔水凝胶在体内良好的血管化结果。
总的来说,该研究通过镁降解过程产生氢气进行发泡,提出了一种在可注射水凝胶中原位生孔的简单且经济高效的方法。并确定了镁金属颗粒的最佳参数:雾化球形颗粒,平均粒径20μm,浓度为1mg/ml。
体外和体内实验均表明,依赖于镁金属颗粒降解产生氢气的发泡方法可在充满细胞的水凝胶中直接生成多孔结构,同时维持水凝胶的可注射性和细胞相容性。此外,镁金属颗粒降解后产生的镁离子能够促进骨生物功能,对于将来在骨组织工程再生中的应用极具潜力。
这项制备多孔水凝胶的方法,有望以微创方式促进深部和封闭性骨缺损的再生,并且可延伸应用于医用敷料、药物递送、废物吸附、3D打印等诸多领域。
据悉,博士研究生唐艳梅、林思涵为该论文共同第一作者,蒋欣泉教授、张文杰博士为共同通讯作者。这项工作得到了国家自然科学基金,国家重点研究发展计划和上海交通大学医学院博士创新基金项目的共同支持。
















.jpeg)













