全球范围内,约有5000万人正深陷阿尔茨海默症(AD)的困境,而随着人口老龄化趋势的不断加剧,世界卫生组织预测,到2050年,阿尔茨海默症患者的人数将飙升至1亿。然而,与这一迅速增长的患者人数相比,目前可用的治疗手段却显得捉襟见肘。

回顾以往,阿尔茨海默症(AD)的研究过程漫长又曲折,自1901年德国神经病理学家爱罗斯·阿尔茨海默(AloisAlzheimer)首次发现并命名此疾病以来,关于阿尔茨海默症的理论与假说层出不穷,诸如β-淀粉样蛋白斑块说、Tau蛋白说以及炎症说等。然而,尽管这些理论催生了众多药物,但仍未能从根本上逆转AD的病程发展。
不少研究者开始深思:鉴于AD是由多重因素共同作用的结果,仅针对单一病理特征的治疗策略或许难以实质性改变疾病的临床进展。因此,阿尔茨海默症患者迫切需要一种具备多效性作用机制(MOA)的药物。

在这一背景下,间充质干细胞崭露头角,成为潜力巨大的候选药物。近日,美国Longeveron公司发布了其旗下同种异体间充质干细胞(MSC)药物Lomecel-B在治疗轻度AD方面的新进展。
该药物的2a期CLEARMIND试验补充结果显示,细胞治疗能够显著减少患者脑部与AD相关的脑容量损失,降幅高达49%。
同时,它还能有效减轻脑神经炎症,改善脑血流量及认知功能。这些令人振奋的数据进一步印证了间充质干细胞在治疗AD领域的巨大潜力,为广大患者带来了新的曙光。

多效性机制揭示,
干细胞是阿尔茨海默症治疗新曙光
尽管“β-淀粉样蛋白斑块说”与“Tau蛋白说”在阿尔茨海默症(AD)的研究中占据主导地位,但科学家们也深刻认识到炎症状态在痴呆表现中的关键作用。
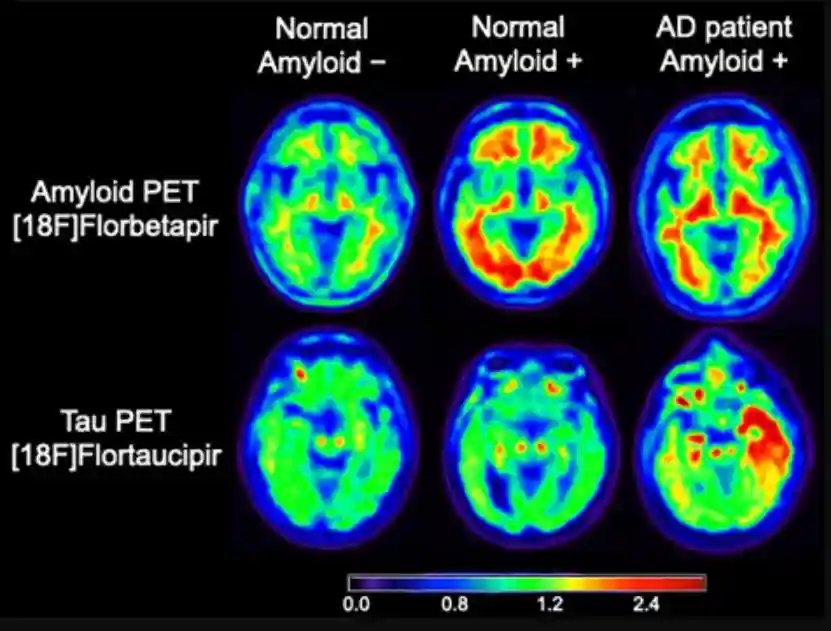
研究观察显示,促炎因子常在淀粉样蛋白沉积和神经原纤维缠结周围聚集,且全身性炎症与Aβ积聚之间存在明显联系。
此外,神经血管损伤也是导致AD的另一个重要因素,特别是血脑屏障(BBB)的破坏和跨内皮交换功能的减退,这些都会降低大脑中Aβ肽的清除效率,导致其积累。
那么,如何解决这一系列问题呢?具有多效性作用机制(MOA)的多能干细胞——间充质干细胞(MSC)吸引了研究者的目光。之前的多项研究已经证明,MSC能够在细胞层面上提供全面的通讯机制,通过异细胞偶联以及释放细胞因子、生长因子和其他生物活性分子来发挥抗炎和促进血管再生的作用。
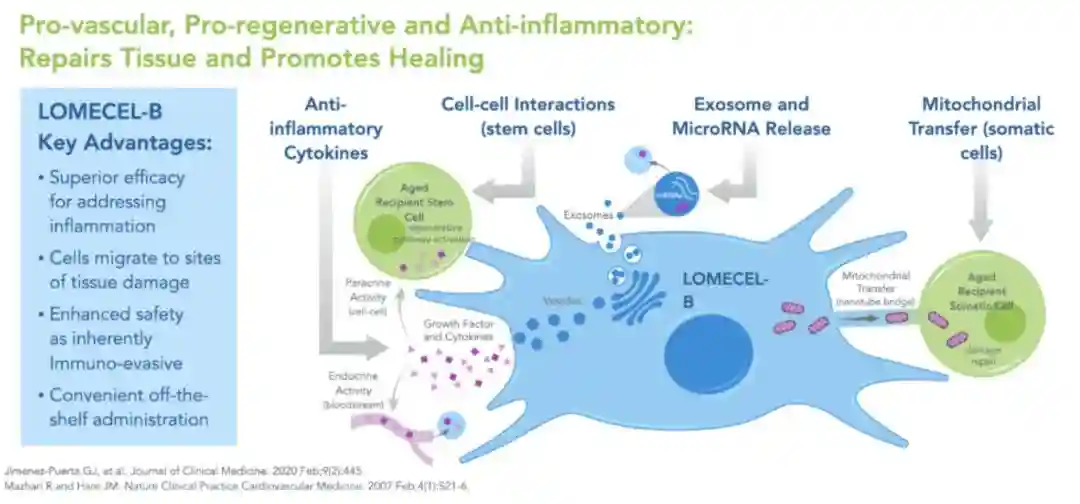
多效性作用机制(MOA)
再者,MSC享有免疫特权,即使输注来自不同个体的MSC,也很难触发机体的免疫排斥反应,其安全性在衰老相关虚弱和心脏疾病的治疗中已得到验证。
这些特性使得MSC在AD治疗领域备受瞩目。2020年,AdvancedScience(影响因子:15.1)上刊登的一篇文章指出,脐带间充质干细胞具备修复受损神经细胞的能力,并能通过HGF-cMet-AKT-GSK3β通路调节tau蛋白的磷酸化,从而显著提升阿尔茨海默病模型动物的学习和记忆能力以及认知能力。这为MSC在改善阿尔茨海默症方面的应用提供了有力的临床前证据。

在2021年,Longeveron公司公布了其研发的骨髓源间充质干细胞药物——Lomecel-B,在治疗阿尔茨海默症方面的1期临床试验成果。
此次研究共纳入了33位轻度阿尔茨海默症患者,他们被随机分为低剂量组(接受单次静脉输注2x107的剂量)、高剂量组(接受单次静脉输注1x108的剂量)以及安慰剂组。试验结果显示:
对轻度阿尔茨海默症患者进行间充质干细胞(MSC)药物的输注是安全的,且患者对该药物的耐受性良好;
接受MSC输注的患者在多项抗炎血清生物标志物上显著高于安慰剂组,这为MSC具有促进抗炎环境的能力提供了支持;
该药物能够改善接受治疗患者的神经认知功能,并提高他们的生活质量。
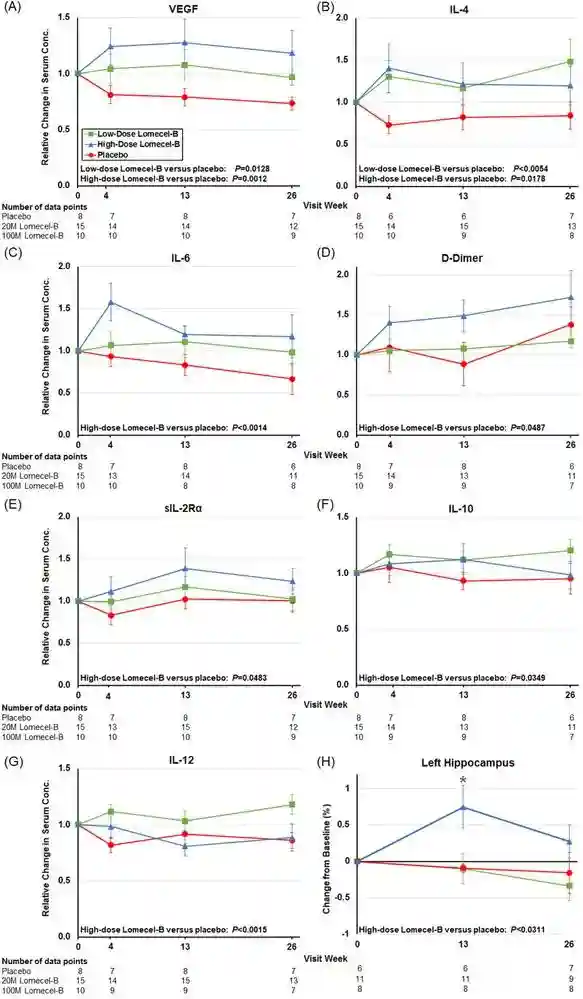
次要和探索性生物标志物终点:
与炎症和血管功能以及海马体积相关的血清生物标志物的变化
这项研究的积极成果极大地鼓舞了研究者们,同时也为后续更大规模的临床试验奠定了坚实基础。正因如此,在1期研究刚刚圆满结束后,科学家们便迫不及待地启动了下一阶段的研究工作。

减少49%脑容量损伤,
干细胞为阿尔茨海默症患者带来新希望
名为CLEARMIND的2a期临床试验于2021年12月正式启动,共招募了50位年龄在60至85岁之间的轻度阿尔茨海默症患者,其中49人接受了治疗。该研究依据美国国立卫生研究院-阿尔茨海默氏症协会(NIA-AA)的标准进行。
在本次研究中,科学家们测试了三种不同剂量的Lomecel-B以及安慰剂的效果,主要考察的是治疗的安全性,同时次要考察指标包括复合阿尔茨海默症评分(CADS)从研究开始到第39周的变化。此外,还探索了脑容量和认知功能等其他指标。
经过近两年的精心研究,2023年10月,Longeveron公司公布了这一临床试验的结果。
所有实验组均达到了安全性的主要考察指标,与预期的安全性概况相符合。在整个试验过程中,未出现超敏反应、无阿尔茨海默病相关想象异常(ARIA)的病例,且磁共振成像(MRI)也未显示临床无症状的微出血情况。
在次要考察指标方面,与安慰剂组相比,注射间充质干细胞(MSC)的患者在CADS和左侧海马体积等方面显示出数值减慢和预防疾病恶化的趋势,且这一差异具有统计学意义。

更为引人注目的是,患者在身体上出现了直观的改变——他们的大脑结构也有所改善。阿尔茨海默症患者的大脑通常会经历进行性萎缩,导致脑容量和皮质厚度减少。然而,2a期研究显示,Lomecel-B有可能减缓与阿尔茨海默病相关区域(如海马、脑室、丘脑等)的脑容量损失。
值得一提的是,在输注高剂量(100Mx4次)的情况下,全脑体积的损失减少了高达49%。
此外,与安慰剂组相比,所有接受MSC治疗的剂量组在第39周时通过DTI测量的神经炎症水平均较低。

2a期试验的额外阳性临床数据和成像生物标志物结果
Longeveron公司的首席执行官Wa'elHashad对此表示:“这些新数据进一步支持了我们10月份公布的CLEARMIND初步结果,验证了Lomecel-B在治疗轻度阿尔茨海默病方面的安全性和潜力。”随着研究的不断深入和各方共同努力,我们有理由相信,不久的将来会看到更多令人振奋的成果。
细胞科技作为新兴技术,为众多阿尔茨海默症患者点燃了希望之光。其不仅在治疗阿尔茨海默症方面展现出巨大潜力,还在推动新型阿尔茨海默症药物的研发方面发挥了重要作用。

例如,有研究者结合了人类诱导多能干细胞(iPSCs)技术和CRISPR技术,构建了一个能够系统揭示小胶质细胞状态调控因子的平台,从而实现其功能表征和治疗靶向,为开发阿尔茨海默症的新疗法开辟了新途径。
值得一提的是间充质干细胞不仅在阿尔茨海默症的治疗中发挥了重要作用,而且在心脑血管疾病、其他退行性疾病(如帕金森、骨关节炎)以及自身免疫性疾病等领域也展现出了广阔的应用前景。细胞疗法正凭借其独特的优势攻克着上百种疾病,为无数患者带来了希望的曙光。
































