人生小哲理
静下心来
潜心研究
我们将走的更远
正文
未来的一天,也许细胞治疗就如今天的小分子药物一样生产简单、价格低廉,那时候也许我们就进入了细胞治疗的新纪元。撰文:MING(奇迹之光)●●●
1理想的细胞治疗方式
CAR-T细胞产品,主要流程是从病人的外周血中分离单个核细胞,激活后通过慢病毒转染CAR结构,再回输到病人体内。这种方法在产业应用上面有一定的局限:

1.自体使用,每次采集只能给单个病人使用,不能规模化生产。
3.有限的细胞数量影响临床应用。
4.细胞的改造效率较低,转染效率大概在30-50%;对于NK细胞,转染可能会是更难的一个技术点。
5.一般是混合细胞产品,在质检、安全性、临床申报方面都有一定的挑战。
未来更理想的细胞治疗方式,应该具备以下几个特征:
细胞易改造,可避免如病毒转染效率低等技术问题。
治疗终产品为均一细胞,易于鉴别,从而降低生产、质检,以及申报难度。
可规模化生产,降低成本。
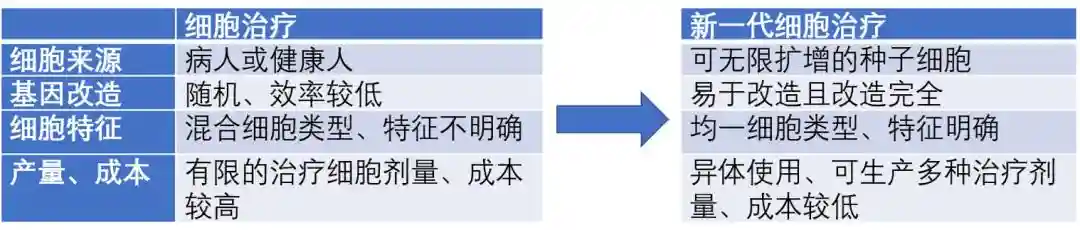
图1.理想新一代细胞治疗具备的优势
2走进诱导多能干细胞新时代
iPSC基本知识
2006年,日本京都大学山中伸弥(ShinyaYamanaka)团队在《细胞》上率先报道了诱导多能干细胞的研究。
他们把Oct3/4,Sox2、c-Myc和Klf4这四种转录因子基因克隆入病毒载体,然后引入小鼠成纤维细胞,发现可诱导其转化为一种新细胞,即诱导多能干细胞iPSC。iPSC在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等方面都与胚胎干细胞极为相似,具备和胚胎干细胞一样的应用潜能。iPS技术在问面世短短5年后,就获得了2012年诺贝尔生理学医学奖。
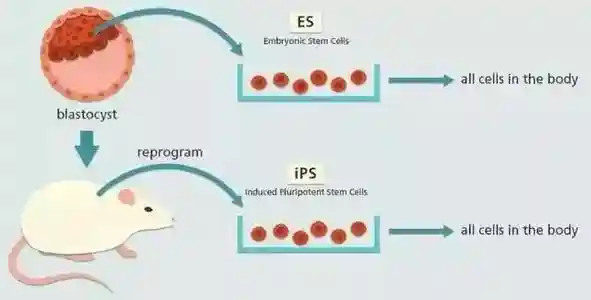
图2.诱导多能干细胞的流程
经过十几年的技术优化,现在iPSC已经可以从多种体细胞(包括血液、尿液、皮肤等)中诱导产生。各种重编程技术的区别主要在于:转录因子的选择以及载体的使用。其技术路径主要分为病毒转染、质粒电转以及小分子诱导。

图3.重编程诱导技术的优劣势对比
iPSC独特的产业化优势
iPSC与其他两种干细胞相比,具备如下优势:
没有伦理问题
可个体化的制备,免疫排异小
具备强分化能力,能分化出不同的功能细胞;
可无限扩增,可降低成本且细胞一致性高(图4)。
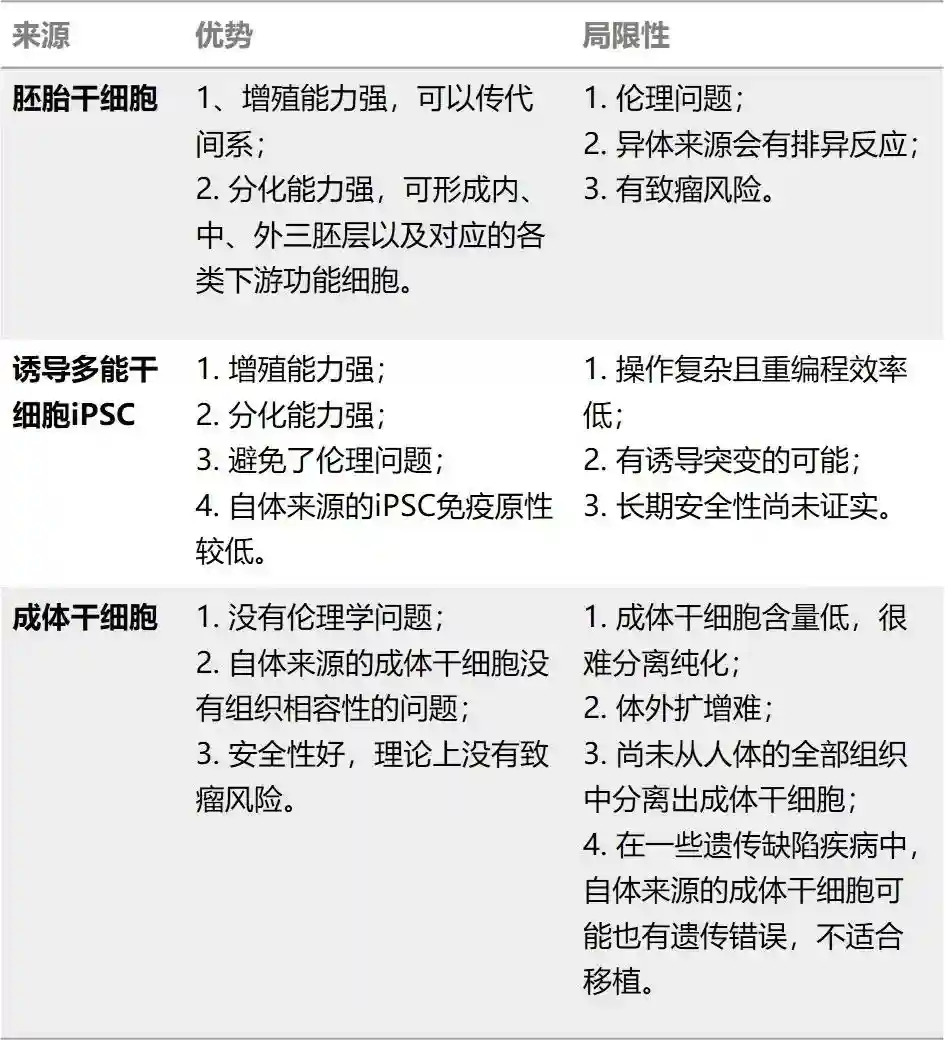
图4.三种主要干细胞的优劣势对比
iPSC在CAR-NK方面的优势
在早期应用中,iPSC有分化效率低和iPSC残留致癌的安全性问题。因此,在临床应用的推广以及适应症的选择方面有较大的局限性。随着iPS技术的不断发展,在癌症治疗方向的应用得到了一定的突破。
近两年,FateTherapeutics获批了数款通过iPSC制备的CAR-NK的IND和CAR-T细胞治疗的IND。由于晚期肿瘤患者再次致瘤的可能性低,对于安全性风险的承担能力更强。因此,病人和医生对于这个新技术的接受度更高。另一方面,iPSC可以提供给病人成本低廉、细胞均一性好的细胞产品。因此,这个方向收益风险比高,是iPSC较好的市场切入点。
FateTherapeutics临床进展最快的产品线为CAR-NK细胞。NK细胞和T细胞相比安全性更高,且可以异体使用。iPSC生产的CAR-NK产品将进一步放大CAR-NK的优势,具备着极强的市场竞争力:
1.CAR-NK安全有效,且可异体使用
细胞数据显示iPSC分化的NK细胞具备同样的杀伤作用,因此预计在临床上,也将有一定的有效性。
有效性好:根据2020年的NEJM发表的论文数据,CD-19的CAR-NK治疗的11名患者中,在平均随访时间达到8个月的观察中,接受治疗的11名患者有8例存在客观缓解,客观缓解率高达73%。而在这8例患者中,更有7名患者是完全缓解[3]。
安全性好:NK细胞不会产生CRS细胞因子风暴以及神经毒性,因此相对于CAR-T的安全性更好。CAR-NK的安全性已在多个临床研究中都被证实。
可异体使用:异体NK细胞的抗肿瘤活性在造血干细胞移植治疗血液恶性肿瘤中已得到证实。相比T细胞,供体NK细胞更有利于移植治疗,且具备抗感染和减少癌症复发的优势,不会引起移植物抗宿主病(GVHD)和移植物抗肿瘤(GVT)效应。另外因为NK细胞本身代谢较快,因此不会长期在体内滞留引起后续的免疫反应。
FateTherapeutics做过一个iPSC分化的NK和健康供体提供的NK细胞的头对头对比,数据显示其FT500产品(i-NK)对于肿瘤的杀伤能力比健康供体的NK细胞更加好(图5)。
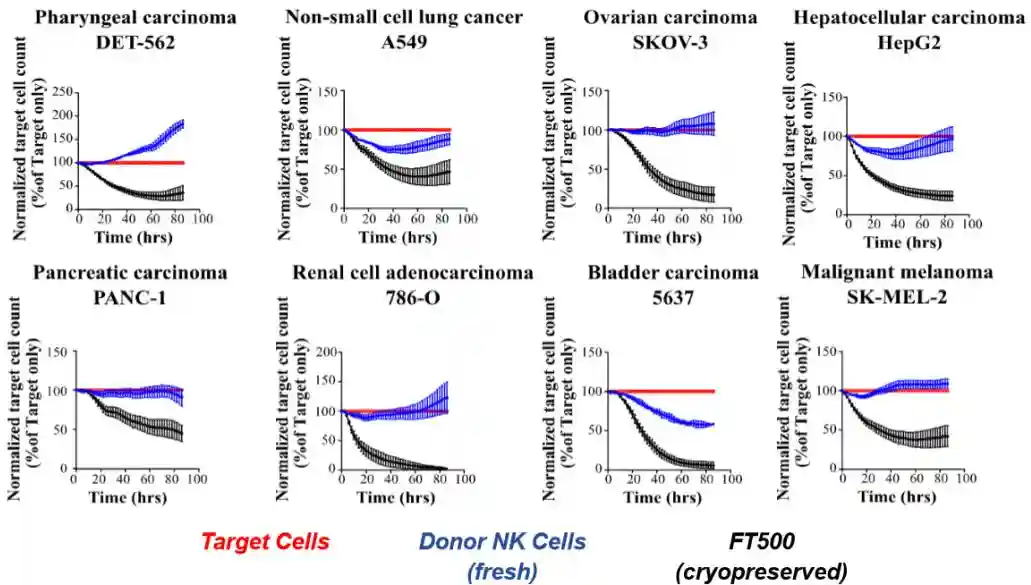
2.iPSC可以大大降低CAR-NK生产成本
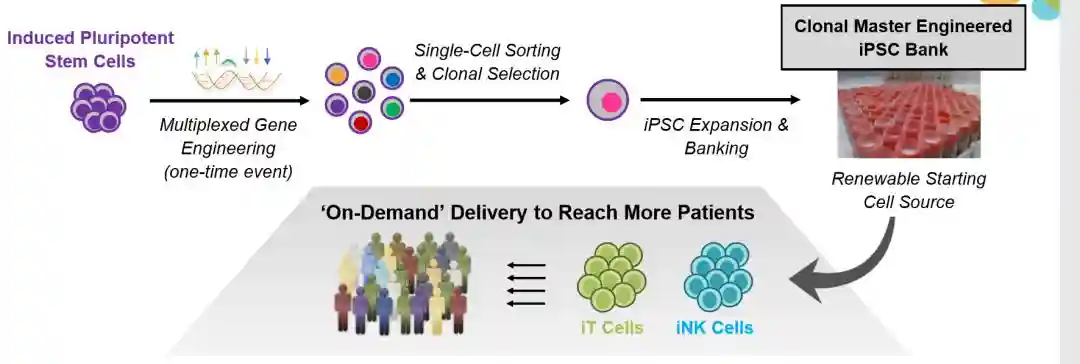
3.iPSC制备的CAR-NK产品
通过基因改造,iPSC可以加上CAR结构,或者是带上不一样的甚至是多个CAR的靶点。改造完成后,下一步只需要挑选出满足条件的iPSC,即可进行下游的免疫细胞分化,形成T细胞、NK细胞、巨噬细胞等。
经过单一改造后的iPSC分化出来的细胞,理论上100%带有同样的改造结构,只要分化成熟,最终产品将具备极高的均一性。这不但解决了CAR低转染效率、基因改造低效率等技术难题,而且在生产质控、临床申报方面更加有优势(图6)。
基因编辑技术让iPSC如虎添翼
如上所述,iPSC可以避免基因改造效率低等技术问题。因此,随着基因编辑工具的发展,iPSC的应用潜力更为突出[4]。以免疫细胞治疗为例,可做以下几方面的改造:
1)制备通用型免疫细胞治疗产品
将iPS细胞TCR等基因敲除,这种iPSC分化出来的T细胞,既避免了宿主对输注CAR-T细胞的免疫排斥,也避免了异体T细胞对宿主器官的免疫攻击(GVHD),可作为通用型细胞产品。
FateTherapeutics在今年拿到了美国FDA的第一个用iPSC分化出来的CAR-T产品的IND。现在还有多个通过基因编辑将iPSC的免疫原性降低的技术路径,iPSC通用性的实现能使其在更多的再生医学领域发挥作用。
2)基因编辑可加入所需要的CAR的靶点
在iPSC上面加入CD19、CD20、Mesothelin等单个或者多个靶点,可以提高免疫细胞的有效性,并降低癌症的复发率;
3)通过基因编辑改造iPSC
通过修正基因缺陷的部分,分化成功能性细胞。用于治疗基因缺陷导致的疾病。现在已有多个临床前试验在进行相关的研究(图7)。
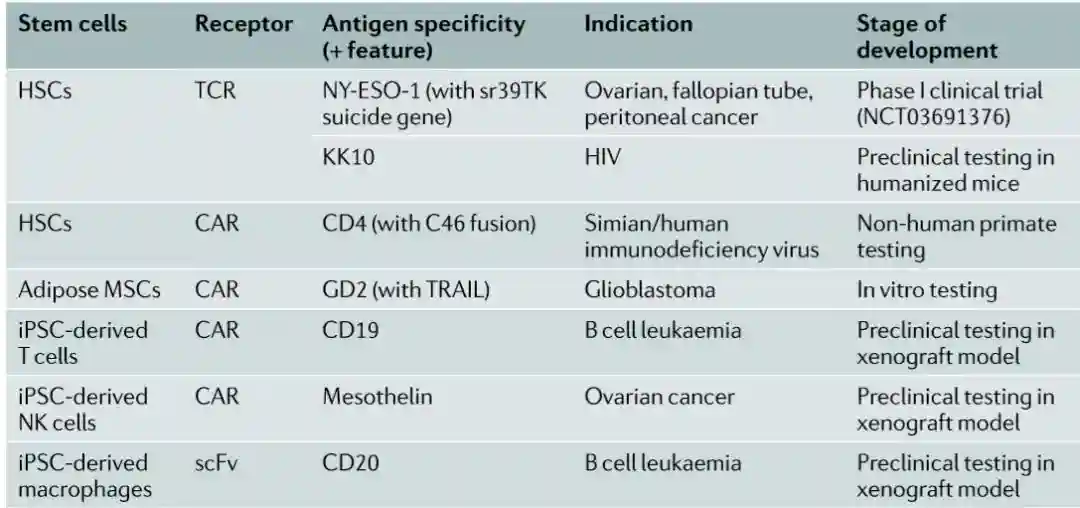
图7.部分临床前研究
3全球处于IND阶段的iPSC产品
iPSC的临床应用刚开始发展,产业应用尚属早期阶段。医疗级的应用包括:疾病治疗、器官移植、生物修复等,也可以通过细胞生产需要的产物,如血小板等。临床应用方面以日本的进展最快,应用方向最多,其次为美国、澳大利亚等。
全球范围内已有多个产品进入了临床或者是拿到了IND(图8)。常见的应用方向,包括眼科类的退行性疾病(黄斑变性)、神经退行性疾病(如阿兹海默症、帕金森病)、癌症等。其他系统性疾病的在研方向,包括1型糖尿病、心衰等。
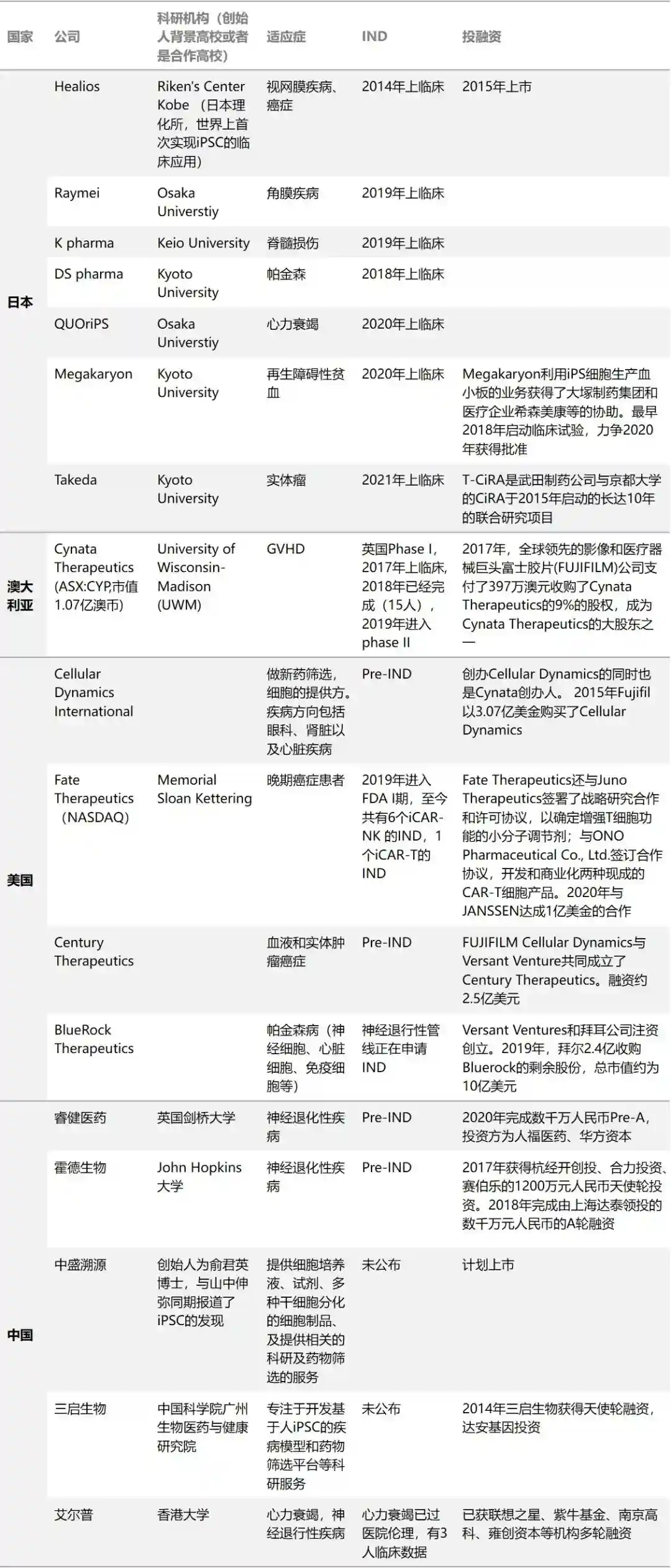
图8.全球部分iPSC公司的临床进展(奇迹之光分析整理)
除了上述提到的医疗级应用,iPSC在科研服务、新药筛选以及消费级的应用方面也逐渐崭露头角(图9)。
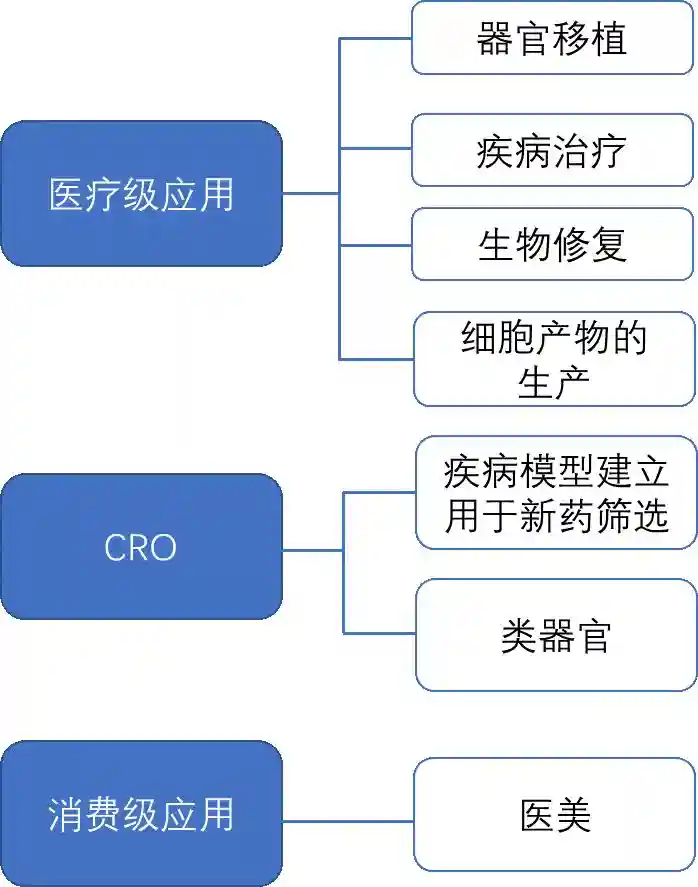
图9.iPSC的潜在应用方向
4诱导多能干细胞产业发展难点
iPSC的产业发展难点,包括但不限于如下几个方面:
诱导效率
iPSC诱导效率需要满足临床需求,且诱导出来的iPSC需要具备多能分化潜力。如果诱导效率过低、临床使用成本高、操作难度大、iPSC的干性不足导致分化潜力过低,那么iPSC的应用场景也将受到限制。
工艺探索
iPSC大部分还处于科研阶段,要达到临床应用的级别,需要摸索相关工艺并具备临床级别的细胞诱导、培养、生产、制备等方面的硬件及软件的能力。如果需要结合基因编辑等技术,还涉及到病毒培养、转染等流程,这将进一步增加对于厂房、质控、人员培训等方面的要求。
安全性问题
由于没有经过大规模的临床试验,iPSC的安全性尚未被验证。对于安全性的主要顾虑在于iPSC残留导致的致瘤性,或者是iPSC在诱导过程中产生的基因核型及基因稳定性的问题等。同时,iPSC免疫原性也是尚在研究中的潜在问题。
市场与监管
iPSC的应用面临着市场与监管等方面的难点。虽然现在干细胞治疗需要严格依从药物审批流程,但是市场上仍然存在未经获批的干细胞产品。2016年的数据显示,美国非监管批准的提供干细胞产品的诊所高达570家。因此在监管层面以及消费者教育方面,确保市场上提供的是正规审批过的干细胞治疗及产品是行业的一大挑战。
主要参考资料:
[1]FDA:MarketaccessofcellularandgenetherapyproductsintheUSandEU
[2]Fiormarkets:GlobalCellTherapyTechnologiesMarketbyProduct(Consumables,Equipment,Software),CellType(HumanStemDifferentiated,Animal),Process,User,Region,GlobalIndustryAnalysis,MarketSize,Share,Growth,Trs,andForecast2018to2025
[3]NewEnglandJournalofMedicine2020;382:545-53
[4]NatureReviewsDrugDiscovery2020;19:463–479
—END—

-科普情怀责任-